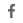22년 CAR-T 최근소식
페이지 정보
작성자 HK HIS 작성일22-11-27 21:05 조회2,438회 댓글0건관련링크
본문
CAR-T(키메라 항원 수용체 T 세포 면역 요법), 치료법은 새로운 유형의 세포 치료법입니다. 급성백혈병과 비호지킨림프종의 치료에 탁월한 효과가 있어 가장 유망한 종양치료제 중 하나입니다 모든 기술이 그러하듯 CAR-T 기술도 오랜 진화 과정을 거쳤습니다.
이 새로운 치료 전략의 핵심은 표적 세포를 인식하고 유전자 변형 후 환자의 T 세포가 발현할 수 있는 키메라 항원 수용체(CAR)라고 불리는 인공 수용체입니다. 임상 시험에서 과학자들은 연구 과정을 통해 환자에게서 일부 T 세포를 추출한 다음 유전적으로 변형하여 T 세포가 이 새로운 수용체를 발현할 수 있도록 CAR을 코딩하는 유전자를 도입했습니다. 이 유전자 변형 T 세포는 연구실에서 증식된 다음 환자에게 다시 주입됩니다. 이 T 세포는 표적 세포 표면의 분자에 결합하기 위해 발현하는 CAR 수용체를 사용하며, 이 결합은 T 세포를 매우 강력하게 활성화시켜 표적 세포를 빠르게 파괴하는 내부 신호의 생성을 촉발합니다.
최근에는 급성백혈병, 비호지킨림프종 치료 외에 고형종양, 자가면역질환, HIV 감염, 심장병 등의 질환 치료에도 CAR-T 면역요법이 개선된 후 활용되고 있습니다. 이를 바탕으로 CAR-T 세포 치료의 최신 진행 상황을 파악해보려 합니다.
1. cBAF가 c-Myc와 상호작용하여 T 세포를 기억 T 세포로 바꾸는 것으로 밝혀졌으며, 이는 CAR-T 세포를 사용하여 고형 종양을 치료할 것으로 예상 됩니다. 전임상 연구에서 St. Jude Children's Research Hospital의 연구원들은 고형 종양에 대한 CAR-T 세포 요법의 가능성을 열어주는 분자 메커니 즘을 발견했습니다. 관련 연구 결과는 2022년 6월 22일 네이처(Nature) 온라인판에 게재될 예정입니다. 공동 교신 저자이자 St. Jude의 면역학과 의장인 Doug Green 박사는 "우리 연구는 T 세포의 기본 생물학에서 가능한 임상 응용으로 확장되어 그 과정의 기본 분자 메커니즘을 탐구합니다."라고 말했습니다. 우리 중 많은 사람들이 활성화된 T 세포인 경우 생애 초기에 일어나는 일이 이후 발달에 영향을 미칩니다. 우리는 T 세포 활성화 초기에 단백질 c-Myc와 복합 cBAF 사이에 있음을 발견했습니다. 상호작용은 세포의 복제 및 생성에 영향을 미칩니다." 이 저자들은 CAR-T 세포의 효능을 개선하기 위해 발견한 분자 정보를 사용했습니다. 그들은 더 많은 기억 T 세포를 생성하기 위해 CAR-T 세포 활성화 동안 cBAF 억제제를 사용했습니다. 한 전임상 모델에서 cBAF 억제제로 처리된 CAR-T 세포는 처리되지 않은 CAR-T 세포보다 종양 성장을 더 잘 제어했습니다. 이 cBAF 억제제로 처리된 CAR-T 세포도 더 오래 그리고 더 많이 생존했습니다. 여러 고형 종양 유형에서 이 고무적인 결과를 재현했습니다. 새로운 연구는 CAR-T 세포가 고형 종양을 보다 효과적으로 죽이기 위해 간단히 변형될 수 있음을 보여주는 최초의 연구 중 하나 입니다.
2.인터페론 γ 수용체 신호 전달 경로는 CAR-T 세포가 고형 종양을 효율적으로 죽일 수 있도록 합니다. 새로운 연구에서 매사추세츠 종합 병원(MGH)의 연구원들은 인터페론 감마 수용체(IFNgR) 신호 전달 경로가 CAR-T 세포 면역 요법에 대한 교모세포종 감수성에 중요하다는 것을 발견했습니다. 다른 고형 종양에서도 동일한 현상이 관찰되었습니다. 이 발견은 혈액 종양과 고형 종양이 CAR-T 세포 요법에 매우 다르게 반응하는 이유를 부분적으로 설명할 수 있습니다. 관련 연구 결과는 최근 네이처(Nature) 저널에 "CAR T cell killing requires the IFNγR pathway in solid but not liquid tumours"라는 제목으로 발표되었습니다. 논문의 제1저자인 레베카 라슨(Rebecca Larson) 박사는 어떤 유전자가 손실되었는지 확인하고 고형 종양이 CAR-T 세포 치료를 피하기 위해 사용하는 저항 메커니즘을 확인할 수 있었습니다. 새로운 연구에서 그들은 CAR을 사용하여 각 종양 세포에 선택적인 공격을 가했습니다. "우리는 녹아웃 후에 어떤 종양 세포가 살아 있었는지 볼 수 있었고 그 세포를 시퀀싱하여 어떤 유전자가 녹아웃되었는지 알 수 있었습니다." Larson과 동료들이 환자의 몇몇을 포함하여 여러 교모세포종 세포중에서 이 CRISPR 녹아웃 스크리닝을 수행했을 때 예기치 않게 IFNgR 신호 전달 경로의 유전적 결실이 CAR-T 세포에 의한 사멸에 내성이 있다는 것을 발견했습니다. Larson 박사는 "이는 인터페론 감마 관련 유전자가 CAR-T 세포 사멸 시 종양 사멸에 필요하다는 것을 의미합니다. 췌장암, 난소암 및 폐암을 포함한 다른 고형 종양 유형에 대한 추가 연구에서도 동일한 것으로 나타났습니다. CAR-T 세포 요법에 대한 내성은 IFNgR 신호 전달 경로의 유전자 손실 때문이었습니다.
3. 4개의 염기 편집 CAR-T 세포가 재발성 또는 불응성 T-ALL 백혈병을 치료할 것으로 예상됩니다. 새로운 연구에서 필라델피아 어린이 병원의 연구원들은 Beam Therapeutics와 협력하여 염기 편집을 사용하여 키메라 항원 수용체(CAR) T 세포(CAR-T) 요법을 개발하고 테스트했습니다. 7CAR8이라는 CAR-T 세포를 정밀하게 결합하여 예측할 수 없는 결과의 위험을 줄이는 것을 목표로 합니다. 연구 결과는 최근 "Cytosine Base Editing Enables Quadruple-Edited Allogeneic CAR-T Cells for T-ALL"이라는 제목으로 Blood 저널에 게재되었습니다. 그들은 7CAR8이 여러 전임상 모델에서 T-세포 급성 림프구성 백혈병(T-ALL)에 대해 매우 효과적이라는 것을 발견했습니다. T-ALL은 재발의 경우 화학 요법에 반응하지 않는 경우가 많고 완치 가능성이 낮습니다. 승인되면 7CAR8은 이러한 환자들에게 효과적이고 생명을 구하는 치료제가 될 것으로 기대됩니다. 염기 편집 CAR-T 세포가 임상적으로 실행 가능한지 여부를 결정하기 위해 암 센터의 주치의인 Caroline Diorio가 이끄는 필라델피아 아동 병원의 연구원들은 Beam Therapeutics, Inc.와 협력했습니다. CAR- ALL에 대한 T 세포가 테스트되었으며, 여기서 CAR-T 세포는 대다수의 T-ALL 세포에서 고도로 발현되는 표면 수용체 CD7을 표적으로 했습니다. CD7이 건강한 세포의 표면에서도 발현된다는 점을 감안할 때, 이들 저자들은 7CAR8을 구축하기 위해 사이토신 염기 편집을 사용하여 4개의 염기 편집을 수행했으며, 이는 4개의 동시 유전자 편집이 있는 최초의 CAR-T 세포라 할수 있습니다. 여러 생체 내 및 시험관 내 전임상 연구에서 이 저자들은 7CAR8이 T 세포 증식에 영향을 미치지 않고 게놈 재배열을 일으키지 않는다는 것을 관찰했습니다. 그들은 또한 7CAR8이 시험관 내 및 생체 내 세포 모델뿐만 아니라 T-ALL의 여러 환자 유래 이종 이식(PDX) 모델에서 매우 활성임을 관찰했습니다. 공동 저자인 Sarah K. Tasian 박사는 필라델피아 아동 병원의 주치의로 현재 연구실에서 또 다른 소아암인 급성 골수성 백혈병(AML)의 전임상 모델에 대한 치료법을 테스트하고 있습니다.
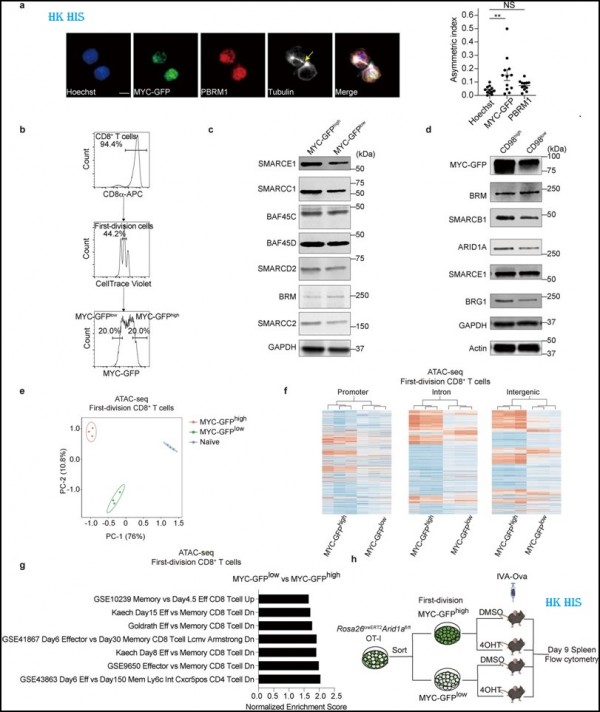
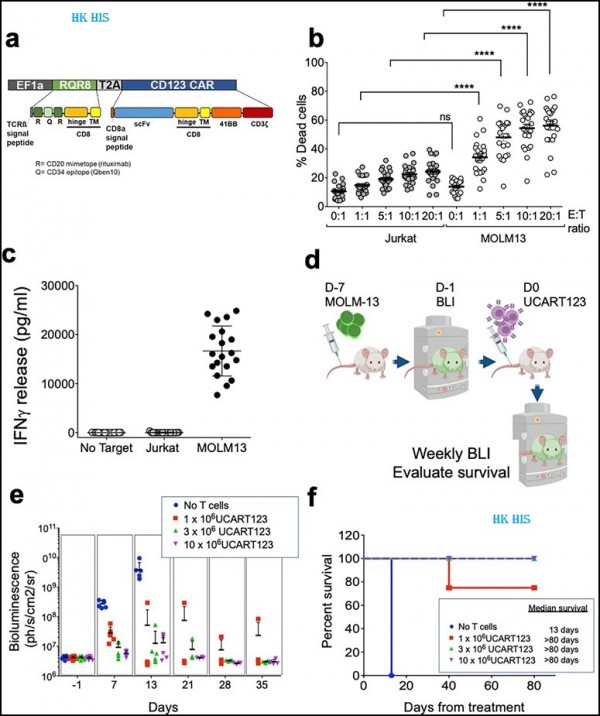
4. Nat Commun: CD123을 표적으로 하는 CAR-T 세포는 백혈병 줄기 세포를 제거하고 AML 백혈병 재발을 예방할 것으로 예상됩니다. 새로운 전임상 연구에서 Weill Cornell Medicine의 연구원들은 유전적으로 조작된 면역 세포(T 세포)가 급성 골수성 백혈병(AML)에서 재발을 유발할 수 있는 특정 암세포, 즉 백혈병 줄기 세포를 성공적으로 표적화한다는 것을 발견하고 이의 효과를 입증했습니다. 현재 임상 1상 시험 중인 새로운 세포 요법은 궁극적으로 AML 환자가 암이 없는 상태를 유지하는 데 도움이 될 수 있습니다. 관련 연구 결과는 최근 네이처 커뮤니케이션즈(Nature Communications) 저널에 "Allogeneic TCRαβ deficient CAR T-cells targeting CD123 in acute myeloid leukemia"라는 제목으로 발표되었습니다.
새로운 연구에서 저자들은 T 세포라고 불리는 면역 세포가 키메라 항원 수용체(CAR)를 생성하도록 하여 T 세포가 암세포 표면의 특정 마커를 인식할 수 있도록 합니다. 이 연구에서 CAR은 백혈병 줄기세포 표면의 CD123 분자에 결합하여 이 CAR(CAR-T)을 발현하는 T 세포가 백혈병 줄기세포를 찾아 공격할 수 있게 합니다. "백혈병 줄기 세포는 표준 화학 요법 약물에 내성이 있고 질병 재발을 유발할 수 있는 백혈병 세포의 하위 집합입니다. CD123은 백혈병 줄기 세포의 표면에서 발견되는 마커이며 이를 타겟으로 하는 연구결과가 발표되었습니다.
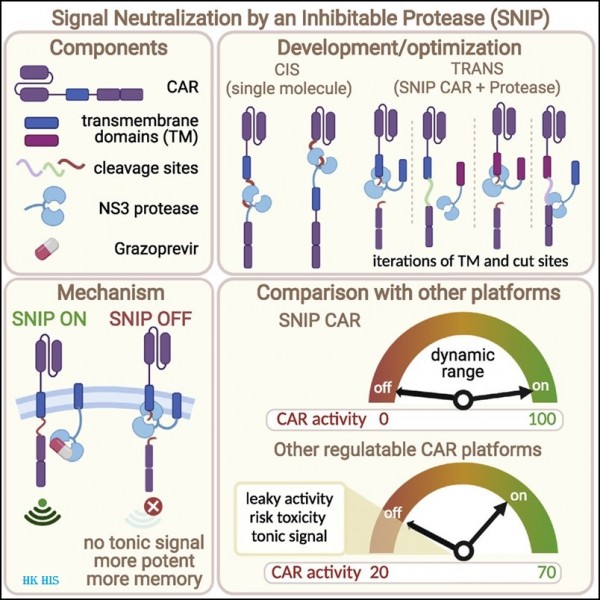
5. CAR-T 세포의 개발은 고형 종양의 치료에 더 안전하고 효과적일 것으로 예상됩니다. 쥐를 대상으로 한 새로운 연구에서 스탠포드 의과대학의 연구원들의 관련 연구는 2022년 5월 12일 Cell 저널에 "Enhanced Safety and efficacy of protease-regulated CAR-T cell receptors"라는 제목으로 게재되었습니다.
저자들은 이미 미국 식품의약국(FDA)이 인간에게 사용하도록 승인한 경구용 항간염제로 활성화될 수 있는 유전자 변형 CAR-T 세포 치료제(SNIP CAR-T)를 설계했다. 약물이 없으면 SNIP CAR-T 세포가 비활성화되었습니다. 선임 저자인 스탠포드 대학의 소아과 교수인 크리스탈 맥컬(Crystal Mackall) 박사는 "우리는 각 환자에게 맞춤화할 수 있는 '원격 제어' CAR-T 세포 치료법을 만들었습니다."라고 말했습니다. 논문의 제1저자인 Louai Labanieh는 "SNIP CAR-T 세포가 기존의 CAR-T 세포 요법을 능가하는 정도에 놀랐습니다. 기존의 CAR-T 세포가 완전히 실패한 곳에서 SNIP CAR-T 세포는 완전히 치료했다"고 말했습니다.
6. Cancer Discov: TIGIT를 차단하게되면 비호지킨 림프종에 대한 CD19 표적 CAR-T 세포 요법의 효능이 향상될 것으로 예상됩니다. 새로운 연구에서 Mayo Clinic, Case Western Reserve University, Cleveland Clinic의 연구원들은 CD19 표적 키메라 항원 수용체(CAR) T 세포(CAR-T) 요법으로 치료받은 환자를 조사했습니다. 관련 연구 결과는 2022년 5월 12일 Cancer Discovery 온라인에 "Sequential single cell transcriptional and protein marker profiling reveals TIGIT as a marker of CD19 CAR-T cell dysfunction in patients with non-Hodgkin's lymphoma"라는 제목으로 게시되었습니다. 최근의 장기 추적 조사 데이터는 비호지킨 림프종 환자에서 CAR-T 세포 치료의 성공률이 감소할 수 있음을 시사한다고 공동 저자인 메이요 클리닉 암센터의 연구원인 황박사는 말했습니다. 황 박사는 “이러한 환경에서 지속 반응률은 30~40% 사이이기 때문에 CAR-T 세포 내성을 측정할 예측 바이오마커를 식별해 환자에게 효과적인 치료법을 더 잘 맞출 수 있도록 하는 것이 중요하다”라고 말했습니다." 저자들은 CAR-T 세포가 환자에게 주입되기 전과 환자에게 주입된 후 다양한 시점에서 단일 세포 RNA 및 단백질 시퀀싱 데이터를 생성했습니다. 황 박사는 새로운 연구가 133,000개 이상의 단일 세포 발현 프로파일을 생성했으며, 데이터를 사용하여 단일 세포 수준 RNA 또는 치료 반응과 관련된 CAR-T 세포의 단백질 발현 패턴을 분석하기 위한 컴퓨터 방법을 개발하고 적용한다고 말했습니다. 이러한 전산 방법을 사용하여 저자는 CAR-T 세포 요법에 반응하지 않는 환자에게 주사된 CAR-T 세포에서 TIGIT라는 유전자가 고도로 발현된다는 것을 발견했습니다. 그들은 또한 TIGIT가 CAR-T 세포 고갈과 기능 장애를 유발한다는 것을 입증했으며 CAR-T 세포 요법으로 TIGIT를 차단하면 생체 내 연구에서 치료 효능을 향상시킬 수 있음을 발견했습니다.
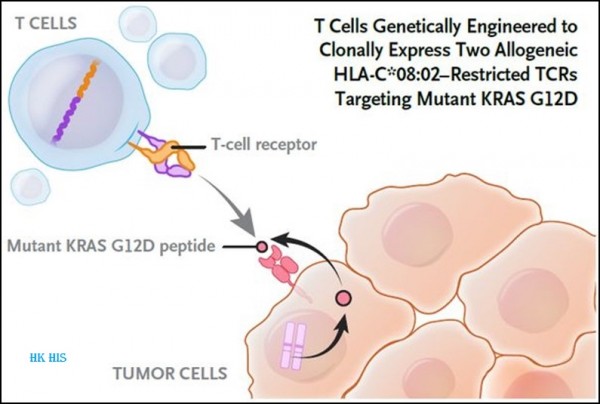
7. NEJM: 연구에 따르면 TCR-T 세포가 췌장암에 유망한 것으로 나타났습니다. 새로운 실험에서 진행성 췌장암을 앓고 있는 캐시 윌크스(Kathy Wilkes)라는 여성이 국립 암 연구소(National Cancer Institute)와 프로비던스 암 연구소(Providence Cancer Institute)의 연구 결과는 NEJM 저널 2022년 6월 2일자 "Neoantigen T-Cell Receptor Gene Therapy in Pancreatic Cancer"라는 제목으로 게재되었습니다.
그들은 Wilkes의 혈액에서 T 세포를 채취하여 실험실에서 TCR을 발현하도록 유전적으로 조작한 다음 TCR-T 세포로 알려진 시험관 내에서 TCR을 발현하는 수십억 개의 T 세포를 키웠습니다. 생성된 TCR-T 세포를 주입한 지 6개월 후 그녀의 종양은 72% 축소되었으며 최근 검사에서 그녀의 상태가 안정적으로 유지되었다고 Wilkes는 말했습니다.
8. 합성 IL-9 수용체는 T 세포가 화학 요법이나 방사선 없이 생체 내에서 암세포를 강력하게 죽일 수 있도록 합니다. 암 종양을 표적으로 하는 T 세포 치료를 받기 전에 환자의 전체 면역 체계가 화학 요법이나 방사선 요법으로 파괴되어야 합니다. 그로 인한 독성 부작용은 잘 알려져 있으며 메스꺼움, 극심한 피로 및 탈모를 경험하게 됩니다. 이제 새로운 연구에서 UCLA의 Anusha Kalbasi 박사가 이끄는 연구팀은 Stanford University 및 University of Pennsylvania의 연구원들과 협력하여 합성 IL-9 수용체가 이러한 암과 싸우는 T 세포를 허용한다는 사실을 발견했습니다. 화학 요법이나 방사선 요법이 필요하지 않은 작업. 그들은 합성 IL-9 수용체를 운반하는 스탠포드 대학의 크리스토퍼 가르시아 박사의 연구실에서 조작된 T 세포가 쥐의 종양을 강력하게 죽인다는 것을 보여주었습니다. 관련 연구 결과는 2022년 6월 8일 네이처 저널에 "Potentiating adoptive cell therapy using synthetic IL-9 receptors"라는 제목으로 온라인 게재되었습니다. "T 세포가 이 합성 IL-9 수용체를 통해 신호를 보내면 기존 면역 체계를 물리칠 뿐만 아니라 암세포를 보다 효율적으로 죽이는 새로운 기능을 획득한다"고 말했습니다. T세포 치료제가 싸울 수 있도록 기존 면역 체계를 없애는 것뿐이지만, 이 신기술로 기존 면역 체계를 미리 제거하지 않고도 T세포 치료제를 줄 수 있을지도 모른다"고 말했다
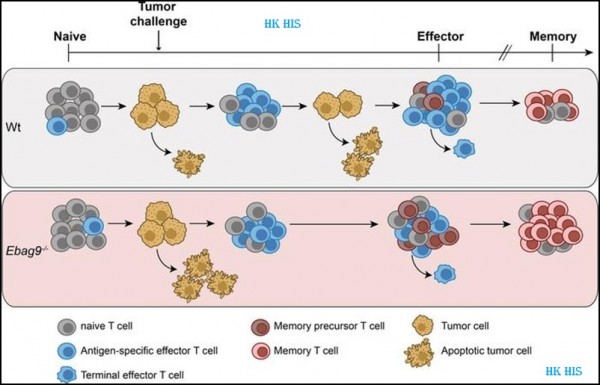
9. JCI Insight: EBAG9를 표적으로 하면 T 세포에 대한 항암 면역 반응이 향상됩니다. T 세포는 일반적으로 병든 세포를 제거하는 데 능숙하지만 종양 세포에 관해서는 실패한 것처럼 보입니다. 새로운 연구에서 독일 막스 델브뤼크 분자 의학 센터(Max Delbrück Center for Molecular Medicine)의 연구원들은 이 면역 기능을 억제하는 요인과 이를 해제하고 암에 대한 면역 반응을 개선할 수 있었던 방법을 설명합니다. 관련 연구 결과는 최근 JCI Insight 저널에 "EBAG9 controls CD8+ T cell memory formation responding to tumor challenge in mice"라는 제목으로 게재되었습니다. 해당 논문의 교신 저자는 Max-Delbrück 분자 의학 센터의 Uta Höpken 박사입니다. 이 논문의 첫 번째 저자는 Max Delbrück 분자 의학 센터의 Dr. Armin Rehm과 Dr. Anthea Wirges입니다.
저자들은 이제 종양 세포가 신체의 면역 반응을 피하기 위해 사용하는 메커니즘을 발견했습니다. Rehm은 "많은 종양 세포에 특히 EBAG9 유전자를 자주 나타납니다. 이 세포는 자신을 보호하는 단백질을 생성합니다. 그러나 EBAG9는 T 세포도 생성하기 때문에 면역 체계의 세포에도 영향을 미칩니다."라고 말했습니다. 저자는 어떻게 세포억제를 했는지를 발표했습니다. "우리는 EBAG9 유전자를 차단했습니다. 이것은 우리가 T 세포에서 EBAG9의 생성을 차단하고 장기적으로 암에 대한 면역 반응을 높일 수 있음을 의미합니다"라고 Wirges 박사는 말했습니다.
10.과학자들은 인간 고형 종양에 대한 CAR-T 세포 요법의 새로운 잠재적 표적을 발견했습니다. 현재 키메라 항원 수용체 T 세포 요법(CAR-T)은 특정 혈액암의 치료에서 상당한 성공을 거두어 재발성/불응성 질환 환자가 더 오래 살고 건강하게 되지만, 임상 연구에서 세포 요법은 실제로 그렇지 않습니다. 부분적으로 중요한 조직에서 발현되지 않는 종양 표적이 없기 때문에 고형 종양 환자를 성공적으로 치료했습니다. 최근 Molecular Cancer Therapeutics 국제 저널에 게재된 "Olfactory Receptor OR2H1 is effective target for CAR T cells in human epithelial tumors"라는 제목의 연구 보고서에서 Moffitt Cancer Research Center 및 기타 기관의 과학자들은 연구를 통해 확인된 새로운 잠재적 표적입니다. OR2H1이라는 CAR-T 세포에 대해 발견되었으며, 이는 폐암 및 난소암의 성장을 억제하는 데 도움이 될 수 있습니다. CAR-T 세포 요법의 핵심은 환자의 신체 T 세포를 유전자 변형시키는 것인데, 이는 성분채집이라는 과정을 통해 수집된 세포로 암세포의 표면 새롭게 변형된 T 세포(CAR-T 세포)는 환자에게 다시 주입되기 전에 성장 및 증식하도록 자극됩니다. CAR-T 세포 표면의 수용체는 GPS 역할을 하여 특별한 백혈병, 림프종 및 다발성 골수종 환자의 치료를 위해 다양한 CAR-T 세포 요법이 승인되었지만 현재 고형 종양 치료에 대해 승인된 CAR-T 세포 요법은 없습니다. 연구원들은 현재 CAR-T 세포 요법이 고형 종양을 보다 효과적으로 치료하는 데 도움이 될 수 있는 종양 바이오마커를 규명하기 위해 노력하고 있다. 연구진의 목표는 정상 세포가 아닌 종양 세포에서는 발현되는 마커를 찾는 것이다. 연구원인 Jose Conejo-Garcia는 "후각 수용체라고 불리는 단백질군은 비강에서 발현되어 후각 지각을 촉진합니다. 이 기간 동안 연구원들은 OR2H1 단백질이 4가지를 포함한 다양한 고형 종양에서도 발현된다는 것을 발견했습니다. 결장암 샘플의 4%에서 담낭암 샘플의 69%.등등 이는 OR2H1을 표적으로 하는 요법이 정상 세포에 거의 영향을 미치지 않을 수 있음을 시사할 수 있습니다. 이어 연구진은 OR2H1 단백질에 특이적인 CAR-T 세포를 개발했다.OR2H1 CAR-T 세포는 OR2H1을 발현하는 폐 및 난소암 세포를 죽일 수 있지만 건강한 세포에는 영향을 미치지 않는다. 인간 종양에 의해 공격받은 면역 결핍중 항 종양 효과 다양한 수준의 OR2H1을 갖는 폐암 및 난소암 모델에서 연구자들은 화학요법, 난소암 세포 등에 대한 내성을 포함한 특정 종양 억제 효과를 관찰했습니다. 이러한 종합적인 데이터는 OR2H1이 고형 종양에 대한 CAR-T 세포 치료의 유망한 표적이 될 수 있음을 시사하며, 연구자들은 이러한 초기 발견이 다양한 고형 종양 환자를 위한 OR2H1 CAR-T 세포를 개발하는 데 도움이 되기를 희망합니다.
11. 새로운 면역 강화 요법이 인간 혈액암에 대한 CAR-T 세포 요법을 향상시킬 수 있다고 발표했습니다. 유전자 변형 T 세포가 암세포를 공격하도록 자극하는 세포 면역 요법의 발전은 특정 혈액암의 치료에 혁명을 일으켰으며 FDA는 특정 유형의 백혈병, 림프종 및 다양한 유형의 흑색종을 치료하기 위해 6가지 CAR-T 세포 요법을 승인했습니다. 그러나 일부 환자의 종양은 이러한 요법에 반응하지 않았으며 초기에 잘 수행한 많은 환자는 나중에 암이 재발했습니다. 최근 워싱턴 대학의 국제 저널인 네이처 커뮤니케이션즈(Nature Communications)에 "지속성 인터루킨-7, rhIL-7-hyFc가 CAR-T 세포 확장, 지속성 및 항종양 활성을 향상시킨다"라는 연구 보고서가 발표되었습니다. 의대 및 기타 기관의 과학자들은 연구를 통해 이러한 유전자 변형 T 세포를 주입할 때 인터루킨 7(IL-7)이라는 면역 강화 단백질을 사용하는 추가 요법이 암과 싸우는 CAR-T 수를 증가시킬 수 있음을 발견했습니다. 세포가 증가하고 종양 세포를 보다 효율적으로 죽일 수 있습니다. 이 연구에서 연구자들은 난치성 미만성 거대 B형 환자의 재발 또는 결과 치료를 위해 B 세포 항원인 CD19를 표적으로 하는 CAR-T 세포 요법과 함께 장기간 작용하는 유전자 변형 IL-7을 조사하는 임상 시험을 수행했습니다. 세포 림프종(DLBCL). John F. DiPersio, MD는 많은 연구자들이 혈액암 치료에서 CAR-T 세포의 기능을 향상시키기 위해 다양한 전략을 사용하려고 시도하고 있다고 말했습니다. 연구자들은 IL-7이 T 신체가 아플 때 IL-7이 T 세포 수를 증가시키도록 하는 주요 원인이며 CAR-T 세포 요법 후 면역결핍에 투여 장기간 지속되는 IL -7를 연구자들은 관찰했습니다. 이는 세포 활성을 이끌어내는 효과를 입증하였습니다.
HK HIS는 환자를 최신의 의료 기술로 안내하겠습니다.