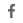삼중 불응 다발성 골수종 환자의 CAR-T
페이지 정보
작성자 HK HIS 작성일21-06-13 12:49 조회1,947회 댓글0건관련링크
본문
미국 레빈암연구소(Levine Cancer Institute) 사드 자파 우스마니(Saad Zafar Usmani) 박사팀은 재발성 또는 불응성 다발성 골수종 환자를 대상으로 한 1b/2상 임상시험 CARTITUDE-1의 18개월 추적관찰 데이터를 4~8일(현지시간) 온라인으로 열린 미국임상종양학회 연례학술대회(ASCO 2021)에서 발표했습니다.
Johnson & Johnson (JNJ)의 자회사 인 Jansen Pharmaceutical는 최근 BCMA 주도 CAR-T 세포 치료법인 ciltacabtagene autoleucel (cilta-cel, 이전에 JNJ-4528/LCAR로 알려짐)을 발표했습니다. 그 결과 이전에 여러 번의 치료를 받은 경험이 있는 재발성 / 불응성 다발성 골수종(RRMM) 환자에서 cilta-cel은 지속적인 효능과 지속적인 완화를 나타냈습니다. 1b/2 CARTITUDE-1 연구 (n = 97; NCT03548207)의 최신 결과에 따르면 18개월간의 장기 추적 조사 결과 객관적 반응률(ORR)이 98%에 도달했으며 환자는 엄격한 완전 관해 (SCR)를 달성 하였습니다. 18개월에 환자의 66% (95% CI : 54.9-75.0)가 살아 있고 재발이 없었습니다. 2021년 ASCO 연례 회의에서 발표 될 최신 연구 결과에 따르면 중앙 추적 기간이 18개월 인 경우 전체 생존율 (OS)은 81% (95% CI : 71.4-87.6), 관해율이 나타났습니다. CARTITUDE-1 연구 데이터는 미국 FDA에 제출 된 cilta-cel 생물학적 제품 라이센싱 신청서 (BLA)를 지원하며, 이는 최근 FDA 가 우선 검토를 위해 승인 했습니다 . 또한 cilta-cel은 유럽 연합 EMA에 의해 가속화 된 평가를 받고 있습니다. Levin Cancer Institute의 Plasma Cell Disease Department의 연구 책임자 Saad Z. Usmani는 다음과 같이 말했습니다. "cilta-cel로 치료 한 다발성 골수종 환자에서 무 진행 생존 가능성이 증가하고 효과가 계속해서 유지 될 것입니다. 이러한 결과는 cilta-cel이 다발성 골수종 환자에게 중요한 새로운 치료 옵션을 가져올 것임을 나타냅니다.”
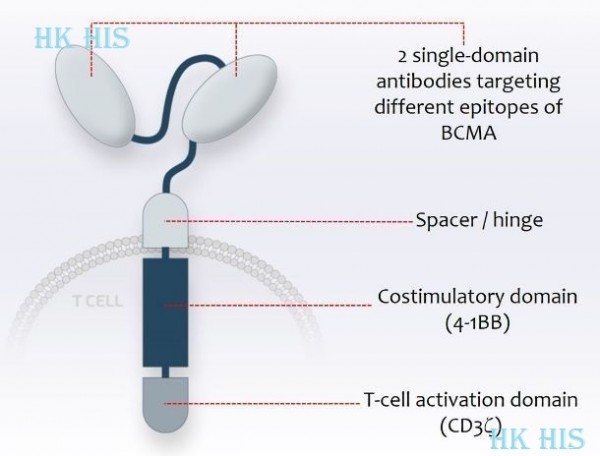
cilta-cel은 재발성 또는 불응성 다발성 골수종 (RRMM)의 치료를 위한 B세포 성숙 항원 (BCMA) 유도 키메라 항원 수용체 T세포 (CAR-T) 요법입니다. cilta-cel은 환자 자신의 T 세포가 암을 표적으로 하고 박멸하도록 재 프로그래밍 되는 자가 세포 CAR-T 요법입니다. cilta-cel은 독특하고 구조적으로 분화 된 CAR-T 세포 치료제로 4-1BB 공동 자극 도메인과 단일 도메인 항체를 표적으로 하는 두 개의 BCMA를 포함하고 있으며, CD8 + T 세포 특성의 우선 확장을 가지고 있습니다. CAR-T 세포는 환자 자신의 면역 체계 힘을 이용하여 암세포를 제거 하는 혁신적인 방법입니다. BCMA는 골수종 세포에서 고도로 발현되는 단백질입니다. cilta-cel은 Genscript의 자회사 인 Nanjing Legend Biotech에서 설계하고 개발했습니다. 2017년 12월 Johnson & Johnson의 Janssen Biotechnology와 Nanjing Legend는 cilta-cel을 개발하고 상용화하기 위한 독점 글로벌 라이선스 및 협력 계약을 체결했습니다. 미국에서 FDA는 2019년 12월에 cilta-cel을 획기적인 약물로 승인했으며, 2019년 2월에 희귀 약물 지정을 승인했습니다. 유럽 연합 집행위원회(EC)는 2020년 2월에 cilta-cel 고아 의약품 지정을 승인하고 2019년 4월에 우선 의약품 지정 (PRIME)을 부여했습니다. 중국에서 식품 의약국은 2020년 8월에 cilta-cel 획기적인 약물 지정 (BTD)을 부여했습니다.
CARTITUDE-1 연구의 업데이트 된 결과:
CARTITUDE-1은 재발성 또는 불응성 다발성 골수종(RRMM)이 있는 성인 환자의 치료에서 실타 셀의 효능과 안전성을 평가하는 진행중인 공개 라벨, 다기관 1b/2상 연구입니다. 이 연구는 97 명의 환자가 등록했습니다. 이 환자들이 이전에 받은 치료의 중앙값은 6명 (범위: 3-18), 88%(n=85)는 삼중 불응성, 42%(n=41)는 5명 중증 및 불응성이었습니다. 99% (n=96)는 마지막 치료에 효과가 없습니다. 이 연구에서 실타셀은 모든 환자를 위해 성공적으로 준비되었습니다. 연구의 Ib상 부분의 주요 목적은 실타셀의 안전성과 용량을 결정하는 것입니다. 2상 부분에서는 실타셀의 효능을 평가하고 1차 평가 변수는 전체 반응률(ORR) 입니다.
최신 데이터에 따르면 차도는 시간이 지남에 따라 심화되며 중앙값은 18개월입니다. 독립 검토위원회 (IRC) 평가에 따르면 환자의 98%가 관해를 달성했습니다 (ORR=98%) . 일부 환자는 완전 관해를 얻었으며 (sCR=80%) 환자의 14%는 부분 관해를 얻었으며 (VGPR=14%) 환자의 3%는 부분 관해를 달성했습니다(PR=3%). 치료에서 첫 차도까지의 중앙값은 1개월 (범위 : 0.9-10.7 개월)이었고 시간이 지날수록 반응은 지속 되었습니다. 최소 잔류 질환 (MRD)을 가진 61명의 평가 가능한 환자 중 92%의 환자가 실타셀 주입 후 중앙값 1개월에 MRD 음성 상태(10E-5)에 도달했습니다. 18개월에서 전체 생존율은 81% (95% CI : 71.4-87.6)였습니다. 본 연구에서 실타셀은 일관된 안전성을 보였으며 장기간의 추적 관찰 기간 동안 새로운 안전성 신호가 관찰되지 않았으며, 3 등급 이상의 사이토 카인 증후군 (CRS) 발생률은 5 %, ≥3 신경이었습니다. 독성은 10 %입니다.
CARTITUDE-2 연구의 첫 번째 결과 :
CARTITUDE-2 (NCT04133636)는 다발성 골수종 치료에서 실타셀의 안전성과 효과를 평가하는 진행중인 다중 코호트 2상 연구입니다. 코호트 A 등록된 다발성 골수종 환자로서 1~3회 치료(PI 및 IMiD 포함)를 받은 후 진행되었습니다. 이 환자들은 모두 레날리도 마이드 치료에 효과가 없었으며, 이전에 BCMA 표적 약물을 투여 받은 적이 없었습니다. 1차 평가 변수는 최소 잔류 질환 (MRD) 10E-5의 음성 비율입니다. 결과는 ASCO 연례 회의 및 EHA 연례 회의에서 처음으로 발표됩니다. 이 결과는 5.8개월의 중앙 추적 관찰을 통해 관해가 확인되었으며, ORR 95%, 환자의 45%가 sCR, 30%의 환자가 CR을 달성했습니다.
참고 문헌: Janssen Reports New Data for BCMA CAR-T, Cilta-Cel, Showing Deep and Durable Responses in Patients with Relapsed or Refractory Multiple Myeloma
HK HIS는 여러분을 임상 및 임상이 완료된 최첨단 치료 기술로 안내할 수 있는 국제적인 의료 정보체계를 구축하고 있으며, 전문화된 병원과 의료진으로 직접 안내하여 높은 신뢰를 구축하고 있습니다.