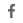면역치료 | CAR-iMac은 CAR-대식세포
페이지 정보
작성자 HK HIS 작성일22-07-03 21:25 조회3,085회 댓글0건관련링크
본문
CAR-T 요법의 개념은 1980년대에 탄생했으며, 2017년 최초의 CAR-T 요법이 FDA 승인을 받았습니다. 오늘날 CAR-T 요법은 혈액종양의 임상 치료에 상당한 효과가 있으며, 종양 치료 분야에서 가장 관심 있고 가장 인기 있는 방향 중 하나입니다. 동시에 CAR-T는 고형암 정복에도 큰 기대를 걸고 있습니다. 그러나 고형 종양의 항원 이질성과 억제성 종양 미세 환경으로 인해 고형 종양 치료에서 CAR-T의 임상 진행은 심각하게 제한됩니다. 다행히 수지상세포(DC), 자연살해세포(NK), 대식세포(대식세포) 등 면역 세포는 고유한 장점을 갖고 있어 CAR-T 외에 더 많은 종양 면역세포치료제로 연구 중에 있습니다.
최근 Zhejiang University School of Medicine/Liangzhu Laboratory의 Zhang Jin 연구팀은 대식세포 분야에 대한 일련의 리뷰와 연구 결과를 발표했습니다. 이 글은 먼저 종양 진행에서 종양 관련 대식세포(tumor-associated macrophage , TAMs) 의 독특한 역할을 소개한 다음, 대식세포의 자가면역 특성과 기능을 도입하여 종양 치료에서의 이점을 체계적으로 설명합니다. 이 기사에서는 M2 면역억제 특성을 갖는 TAM이 고형 종양 침윤 면역 세포의 50% 이상을 차지하며 다중 채널을 통해 고형 종양의 발생 및 발달을 촉진할 수 있다고 언급합니다. 예를 들어, EGF와 같은 성장 인자를 분비하여 종양 세포의 증식 및 침입을 촉진하고, VEGF 및 MMP와 같은 전 혈관 형성 인자를 분비하여 종양 미세 환경에서 혈관 신생을 촉진하고, TGF-β, IL-10 등을 분비함으로써 고형 종양을 생성하는 면역 조절 인자 종양 세포의 면역 억제 미세 환경은 차례로 종양 세포 면역 회피를 제공합니다. 다른 한편으로, 면역 체계의 일원으로서, 대식세포 자체는 항원 의존성 식균 작용(ADCP)뿐만 아니라 다양한 면역 반응의 항원 제시 및 조절을 갖습니다. 이에 기초하여 대식세포 기반 고형 종양 요법이 고형 종양 치료에 실현 가능한 옵션이 되었습니다.
한편, 종양 미세 환경에서 대식세포의 M1 특성을 유지하는 것이 항종양 효과를 발휘하는 열쇠입니다. TAM이 M2 면역억제 상태에서 M1 면역 활성화 상태로 분극화한 다음 항종양 효능을 발휘하는 다중 경로를 통해 TAM이 리모델링될 수 있다고 논문에서 언급되었습니다. 예를 들어, TAM의 세포 내 포도당 대사 및 지질 대사 경로를 M1으로 전환함으로써 CD47 항체는 TAM에서 신호를 차단하고 CD40 및 TLR과 같은 표면 막 단백질의 작용제는 면역 활성을 깨웁니다. TAM 등 그러나 이러한 방식으로는 통제가 어려운 대식세포의 한계를 극복할 수 없고 근본 원인을 치료하기도 어렵습니다. 이 문제에 대응하여 논문에서는 표적 사멸 효능과 항원 의존적 활성화 가능성을 지닌 CAR-대식세포를 얻기 위해 CAR-T 전략과 유전자 조작 대식세포를 사용하면 고형 종양 면역 세포가 치료에 효과를 소개했습니다.
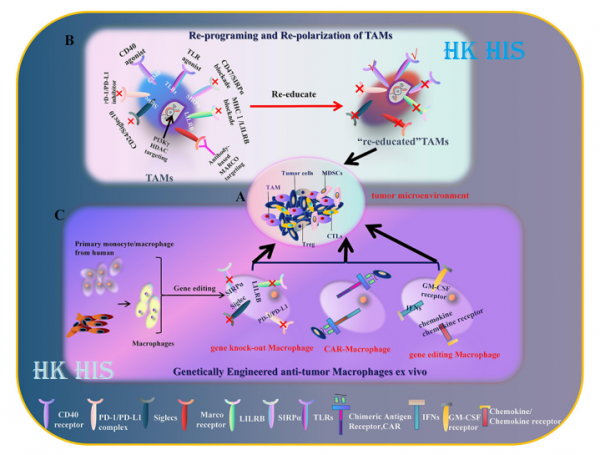
업계에서 대식세포에 대한 광범위한 관심과 급성장하는 연구 열정의 관점에서. 최근에 Zhang Jin의 연구팀과 Fujian Medical University의 Zhang Yi 팀은 저널 Cells에 CAR-대식세포를 암 면역 세포 치료를 위한 새로운 치료 세포 유형으로 유도한다는 관점의 기사를 발표했습니다. 이 문서에서는 현재 종양 면역 세포 치료 연구에 사용되는 CAR-대식세포의 세 가지 주요 소스, 즉 PBMC, THP1 및 iPSC를 요약합니다.
이 논문은 최신 연구 결과를 요약하여 고형 종양 치료에서 CAR-대식세포의 다양한 출처의 장단점을 비교하고 iPSCs 유래 CAR-대식세포가 "강력한", "유전적 조작- "친절한" 및 "무제한"의 장점은 전통적인 환자 자가 PBMC 유래 대식세포 치료 전략에서 긴 준비 주기, 낮은 세포 수 및 유전 공학의 어려움의 결함을 극복하여 더 높은 종양 면역 세포를 갖습니다. 유전적으로 조작된 CAR-대식세포가 이론적으로 효과적으로 종양 미세 환경을 개선하고 고형 종양을 "냉암 종양"에서 "열 종양"으로 변형시키면서 자체 항종양 효과를 발휘할 수 있다는 점은 언급할 가치가 있습니다. 이 논문은 대식세포를 기반으로 한 현재의 항종양 연구에 대한 보다 명확한 방향을 제시합니다.
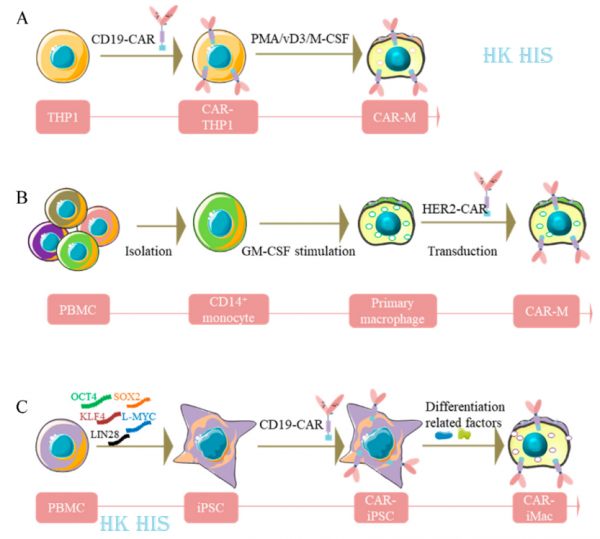
CAR-대식세포는 항종양 효능을 발휘하고 종양 미세 환경을 개선합니다. 위의 이론적 근거를 바탕으로 Zhang Jin의 연구 그룹은 종양 치료를 위해 iPSC 분화 대식세포(iMac)에 대한 많은 연구를 수행했으며 성숙한 기술 시스템을 형성했습니다. 동시에, 유전자 공학의 혁신적인 사용은 CAR-T에서 파생된 CAR(T-CAR)을 iMac에 도입한 다음 대식세포의 표적 사멸 및 항원 의존적 활성화를 달성하는 1세대 CAR-iMac을 얻는 것을 의미합니다. 그 결과는 2020년 J Hematol Oncol 저널에 '항원 의존적 항암 세포 기능을 갖는 만능 줄기세포 유래 CAR-대식세포'라는 제목으로 게재되었습니다.
이 결과는 iMac이 타고난 대식세포의 완전한 발현 프로필과 기능을 가지고 있음을 보여줍니다. 동시에 CD19 표적 CAR(CD19)-iMac은 혈액 종양 세포에 대한 이상적인 표적 사멸 효과가 있고, Mesothelin 표적 CAR(meso)-iMac은 난소 암 세포 에 대한 이상적인 표적 사멸 효과가 있습니다. 마우스 종양 모델에서 항종양 실험도 이 결과를 확인했습니다. 다행히도 CAR의 도입은 IL-1B, IL-6, TNF-α와 같은 염증 인자의 발현도 크게 향상시켜 CAR-iMac이 특정 항원을 인식한 후 면역 미세 환경을 개선할 가능성이 있음을 나타냅니다. iMac이 30일 이상 마우스에서 산다는 점은 주목할 가치가 있습니다. 이 이상적인 생존 시간은 CAR-iMac의 지속적인 항종양 효능을 실현하는 것을 가능하게 합니다. 그러나 대식세포가 다른 생리학적 조건, 즉 "고전적으로 활성화된" M1 분극 상태와 "대안적으로 활성화된" M2 분극 상태에서 뚜렷한 분극 상태를 나타낼 수 있는 것은 강한 가소성 때문입니다. CAR-iMac이 종양 세포에 갇힌 후 암을 촉진하는 M2형 CAR-iMac으로 진화하는 것을 어떻게 막느냐가 그들의 지속적인 치료 효과와 의약 가치를 실현하는 열쇠입니다. Zhang Jin 그룹의 연구는 T-CAR이 CAR-iMac의 항원 의존적 활성화를 달성했지만 면역 관련 인자의 발현을 어느 정도 자극하기도 함을 확인했습니다. 단, CAR-iMac의 연속 편광을 M1 상태로 유지하는 효과는 없습니다. 따라서 M1 분극 촉진 효과가 있는 대식세포 특이적 CAR(M-CAR)을 설계하는 것이 CAR-iMac의 항종양 연구를 발전시키는 열쇠가 되었습니다. 최근 Zhang Jin의 그룹은 Springer Nature 사전 인쇄 플랫폼 Research Square에 2세대 CAR-대식세포 연구 논문을 발표했습니다. 연구팀은 세포 내 신호를 전달하는 CAR의 원리를 이용해 M1 분극을 매개하는 분자의 신호 전달 도메인을 CAR 설계에 혁신적으로 도입하고, M1 분극 기능을 제어할 수 있는 대식세포 특이적 제품을 구축했습니다. M-CAR은 iPSC에서 안정적으로 발현된 후 분화되어 M1-CAR-iMac을 얻었습니다. 종양 보유 마우스 모델에서의 후속 시험관 내 종양 세포 사멸 및 항종양 실험은 모두 M1-CAR-iMac의 상당한 항암 효능 및 항원 의존적 M1 분극 능력을 확인했습니다. 이 전략은 CAR-iMac의 항종양 효과를 크게 향상시켰을 뿐만 아니라 CAR-iMac에서 분비되는 IL-1B, IL-6 및 TNF-α와 같은 전염증 인자의 수준을 더욱 증가시켰습니다. 후속 단일 세포 시퀀싱은 또한 M1-CAR-iMac이 1세대 CAR-iMac과 비교하여 종양 미세 환경에서 상당한 수준의 M1 지속 분극화를 갖는다는 것을 입증했습니다. 이 전략은 CAR-iMacs의 항종양 연구를 크게 발전시켰습니다. 또한 연구 그룹은 대사 재프로그래밍을 사용하여 CAR-iMac에 더 강력한 항종양 기능을 부여하여 CAR-iMac의 더 많은 후속 적용을 위한 견고한 토대를 마련하고 있습니다.
HK HIS는 끊임없이 새로운 연구결과를 전달하여 최신의 치료의 기회를 제공하겠습니다.