면역치료 | 위암 치료에 새로운 표적 CAR-T 임상 결과 발표
페이지 정보
작성자 HK HIS 작성일22-06-19 18:15 조회3,166회 댓글0건관련링크
본문
현재 CAR-T 세포 요법은 종양 면역 요법 분야에서 자리를 잡고 있으며 매우 유망한 요법입니다.시험관 내 T 세포 및 키메라 특이적 항원 수용체를 형질전환함으로써 T 세포에 종양 항원을 인식하고 환자의 종양 세포를 죽이는 독특한 "추적 기능"을 활성화 시킬 수 있습니다.
임상적으로 CAR-T는 불응성 급성 B 림프구성 백혈병과 같은 다양한 혈액 악성종양에서 상당한 효능을 보였습니다. 그러나, 고형암의 경우 여전히 CAR-T 치료에 활발한 연구가 진행 중입니다 [1,2,3].
북경대학의 연구에 따르면 항원 Claudin18.2(CLDN18.2)는 다양한 고형 종양, 특히 소화기 계통 종양에서 고도로 발현되어 CLDN18.2가 잠재적인 치료 표적이 되는 것으로 나타났습니다[4]. 좋은 소식은 초기 임상 연구(NCT03159819)에서 CLDN18.2, CT041을 표적으로 하는 최초의 CAR-T 세포 제품이 위암 및 위식도 접합부 선암종(GC/GEJ)의 치료에 사용되었다는 점에서 효과를 보였다는 것입니다[5]. 이것은 CAR-T 세포가 고형 종양 치료의 병목 현상을 극복할 수 있는 좋은 기회가 될 수 있습니다. 2019년 부터 베이징 대학 암 병원의 Shen Lin 교수 팀은 CLDN18.2 발현 양성(NCT03874897)이 있는 진행된 소화기 계통 상 임상 연구를 공식적으로 시작했습니다 .

결과에 따르면 CT041은 상당한 치료 효과가 있으며 안전하고 제어 가능합니다. 독성, 3등급 이상의 사이토카인 방출 증후군 또는 신경독성 증후군이 없었고, 주입 후 28일 이내에 치료 관련 사망이 발생하지 않았습니다. 소화기종양 환자의 객관적 반응률(ORR)과 질병통제율(DCR)은 각각 48.6%, 73.0%, 위암 환자의 ORR/DCR은 각각 57.1%/75.0%을 보였습니다.
이것은 Claudin18.2 표적을 표적으로 하는 최초의 CAR-T 제품 후보의 데뷔일 뿐만 아니라 현재까지 고형 종양 CAR-T 임상 연구의 결과는 언급할 가치가 있습니다.
이 I상 임상 시험에서 CLDN18.2 양성 진행성 소화기 계통 종양을 가진 총 37명의 환자가 분석에 포함되었으며, 중앙 연령은 53.0세(25-74세)이고 64.9%는 남성(n=24)이었습니다. 그 중 GC/GEJ 환자 28명, 췌장암 환자 5명 , 기타 소화기 계통 종양 환자 4명에서 원격 전이가 발생했으며 환자의 50%는 3개 이상의 장기에 전이가 있었습니다. 모두 기존 치료에 실패한 환자였습니다. 이 환자들은 첫 번째 CT041 주입 후 최대 12주 동안 안전성, 효능 및 평가를 완료했습니다.
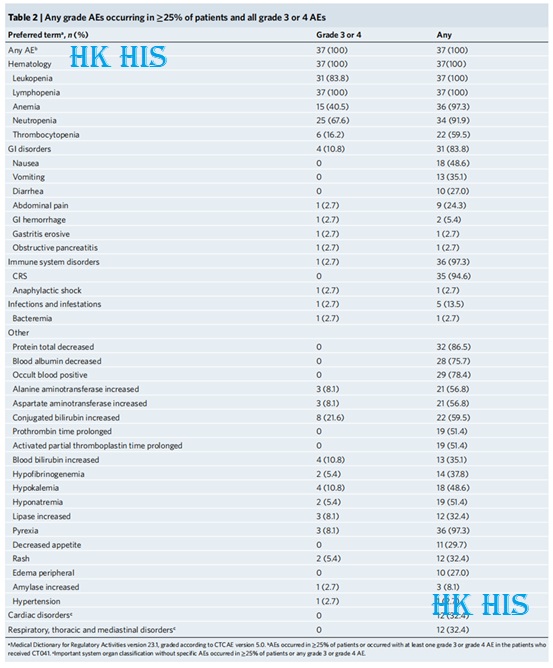
다음은 이 임상 연구에서 Shen Lin 교수 팀이 분석한 데이터입니다. 우선 CT041 치료의 안전성과 약물 내성 면에서 부작용은 일반적으로 통제 가능하다는 결론입니다. 사이토카인 방출 증후군(CRS) 및 면역 효과기 세포 관련 신경독성 증후군(ICANS)은 CAR-T 요법에서 빈번하고 증상이 있는 부작용입니다. CT041을 투여받은 이들 환자 중 누구도 3등급 이상의 CRS 또는 ICAN을 경험하지 않았으며 치료 관련 사망이나 용량 제한 독성(DLT)도 경험하지 않았습니다. 구체적으로, 94.6%에서 1등급 또는 2등급 CRS가 발생했으며 암 유형에 따라 CRS의 빈도 또는 중증도 사이에 명확한 관계가 관찰되지 않았습니다(제한된 표본 크기로 인해 잠재적 연관성을 완전히 배제할 수 없음). 또한 분석 결과 페리틴 피크가 CRS 등급의 임상 지표가 될 수 있음을 보여주었습니다. 또한 모든 환자에서 1차 주입 후 28일 이내에 백혈구감소증(83.8%), 호중구감소증(67.6%), 빈혈(40.5%), 혈소판감소증(16.2%)을 포함한 3등급 이상의 혈액학적 독성이 나타났지만, 평균 4-9일의 시간으로 회복을 보였습니다.
일반적인 치료 부작용
유효성 측면에서 환자의 83.3%가 CT041 치료 후 유의한 종양 퇴행을 보였고, 전체 ORR 및 DCR은 각각 48.6% 및 73.0%에 도달했으며, 전체 환자의 무진행 생존(PFS) 중앙값은 3.7개월, 6개월 전체생존율(OS) 80.1%, GC 환자의 경우 ORR 및 DCR은 각각 57.1% 및 75.0%, PFS 중앙값은 4.2개월, 6개월 OS 비율은 81.2%였습니다.
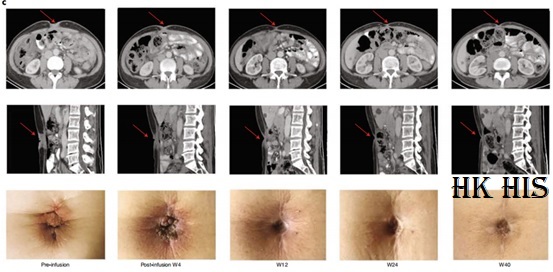
전반적으로 Shen Lin 교수가 주도한 이번 1상 임상 연구의 결과, CLDN18.2를 표적으로 하는 세계 최초의 CAR-T 세포 제품인 CT041이 CLDN18.2 발현 양성인 진행성 소화기암 환자의 치료에 사용된 것으로 나타났습니다. 안전성도 좋았고 3등급 이상의 사이토카인 분비 증후군이나 면역 효과 세포 관련 신경독성 증후군도 없었습니다. 이번 연구에서 CT041의 효능에 대해 혈액종양에서 CAR-T의 성능에 비해 고형종양에 대한 현재 CT041 치료의 의미가 여전히 낮다고 말했습니다(ORR: 70-80% vs 50-60% ). 그러나 현재 위암 치료제인 펨브롤리주맙, 니볼루맙, 아파티닙 등 3차 치료제와 비교하면(ORR: 13.3%[7]; 11.2%[8]; 1.7%[9]), CT041 기존 치료에 실패한 소화기암 환자에게 새로운 가능성이 있는 옵션임에 틀림 없습니다.
참고문헌: 1]Newick, K., O’Brien, S., Moon, E. & Albelda, S. M. CAR T cell therapy for solid tumors. Annu. Rev. Med. 68, 139–152 (2017).
[2]Maude, S. L. et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N. Engl. J. Med. 378, 439–448 (2018).
[3]Hong, M., Clubb, J. D. & Chen, Y. Y. Engineering CAR-T cells for next-generation cancer therapy. Cancer Cell 38, 473–488 (2020).
[4]Marofi, F. et al. CAR T cells in solid tumors: challenges and opportunities. Stem Cell Res. Ther. 12, 81 (2021).
[5]Tureci, O. et al. A multicentre, phase IIa study of zolbetuximab as a single agent in patients with recurrent or refractory advanced adenocarcinoma of the stomach or lower oesophagus: the MONO study. Ann. Oncol. 30, 1487–1495 (2019).
[6]https://www.nature.com/articles/s41591-022-01800-8#Tab2
[7]Fuchs, C. S. et al. Safety and efficacy of pembrolizumab monotherapy in patients with previously treated advanced gastric and gastroesophageal junction cancer. JAMA Oncol. 4, e180013 (2018).
[8]Kang, Y.-K. et al. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 390, 2461–2471 (2017).
[9]Li, J. et al. Randomized, double-blind, placebo-controlled phase III trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction. J. Clin. Oncol. 34, 1448–1454 (2016).