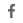면역치료 | 위암, 식도위 접합부, 선암종 및 췌장암으로의 CAR-T
페이지 정보
작성자 HK HIS 작성일23-06-10 11:42 조회1,312회 댓글0건관련링크
본문
2023년 5월 18일, 혈액 악성 종양 및 고형 종양 치료에 중점을 둔 혁신적인 CAR-T 세포 치료제 회사인 Coji Pharmaceuticals(2171.HK)가 미국에서 CT041을 출시했다고 발표했습니다. 최소 2차 치료법에 실패한 CLDN18.2 양성 진행성 위암/식도위접합부 선암종(GC/GEJ) 환자의 치료를 위해 2상 임상이 실시되었습니다.
전 세계적으로 백만명이 넘는 사람들이 위암으로 고통받고 있습니다. 최근 몇 년 동안 질병의 치료가 개선되었지만 진행성 위암 환자의 예후는 여전히 좋지 않으며 사람들의 임상 충족시키기 위한 혁신적인 치료법이 필요합니다. CT041은 이전 임상 시험에서 효과를 입증 안전성을 보여주었습니다. CT041이 진행성 위암 환자에게 효과적인 치료 옵션을 제공할 가능성이 있다고 믿습니다. 동시에 종양 면역치료 분야의 발전을 위해 지속적으로 노력하고 있는 Keji Pharmaceuticals의 연구원 및 모든 직원들에게도 감사의 말씀을 전합니다. 우리는 미래의 임상 개발 진행 상황을 귀하와 공유하기를 기대하며 환자의 치료를 위해 혁신적인 CAR-T 세포 치료법을 개발하기 위한 노력을 계속할 것입니다
CT041은 세계 최초로 CLDN18.2 단백질을 표적으로 하는 잠재적인 자가 CAR-T 세포 제품 후보물질로 주로 위암/ 식도위 접합부 선암종 및 췌장암에 발병되는 단백질 표적으로 Coji의 진행 중인 시험에는 중국에서 연구자 주도 시험(NCT03874897), 진행성 위/식도위 접합부 선암종 및 췌장암에 대한 Ib상 및 진행성 위/식도위 접합부 선암종에 대한 확증적 2상 임상 시험(CT041-ST-01, NCT04581473) 및 진행성 위암 또는 췌장암에 대한 임상 1b/2상 시험(CT041-ST-02, NCT04404595)이 북미에서 시작되었습니다. 2022년 1월 CT041은 CLDN18.2 양성 진행성 위암/식도위 접합부 선암종 치료를 위해 미국 FDA로부터 "재생 의학 첨단 치료"(RMAT) 지정을 받았습니다. 2021년 11월 CT041은 진행성 위암 치료를 위해 EMA로부터 우선 의약품(PRIME) 자격을 부여받았습니다. 2020년과 2021년에 CT041은 미국 FDA로부터 위암/식도위접합선암 치료용으로 "희귀 의약품" 지정을 받았고 진행성 위암 치료용으로 유럽 의약품청(EMA)으로부터 "희귀 의약품" 지정을 받았습니다.
Claudin18.2(CLDN18.2)는 세포막 표면에 존재하는 Claudin 단백질 계열의 일원으로 정상적인 상황에서는 위점막의 분화된 상피세포에서만 낮은 수준으로 발현됩니다. 병리학적 조건에서 Claudin18.2는 다양한 종양에서 발현되며 위장관 선종의 80 %와 췌장 종양의 60 %를 포함하여 발현이 크게 증가했습니다 . 또한 CLDN 18.2 활성화는 식도, 난소 및 폐 선암종 에서도 나타나 므로 잠재적인 암 치료의 표적이 됩니다. Claudin18.2를 표적으로 하는 세계 최초의 CAR-T 세포인 CT041은 2019년 첫 선을 보인 이후 세계를 놀라게 했습니다. 놀라운 치료 효과는 소화기 종양 치료에 대한 좋은 전망을 보여주고 있습니다. 2022년 5월 9일, KEji제약의 CAR-T 세포 제품 CT041의 소화기 종양 치료에 대한 연구 결과가 세계 최고 저널인 "Nature Medicine"에 게재되었으며, 이는 국내 최초이자 최대 규모의 연구이기도 합니다.
1. 초기 효능은 37명 중 36명에서 측정 가능한 표적 병변이 있었고, 이 중 30명(83.3%)이 종양 퇴행을 보였습니다. 모든 환자의 객관적 반응률(ORR) 은 48.6%, 질병 조절률(DCR)은 73.0% , 무진행 생존(PFS) 중앙값은 3.7개월 , 6개월 전체 생존(OS) 비율은 80.1% 전체 위암 환자 의 전반적인 객관적 반응률은 57.1% , 질병 조절률은 75.0% 였습니다 . PFS 중앙값은 4.2개월 이었고 6개월 OS 비율은 81.2% 였습니다 .
2. 2차 이상의 치료에 실패한 위암 환자 : 객관적 반응률은 61.1% , 질병조절률은 83.3% 였다 . PFS 중앙값은 5.6개월 , 6개월 지속반응률(DOR)은 57.1%였습니다.
2022 ASCO 컨퍼런스에서 keji Pharmaceuticals는 다음을 포함하여 CT041에 대한 두 가지 연구 결과를 발표했습니다.
(1) 미국에서 진행성 위암 및 췌장암 환자를 대상으로 한 다기관 1b상 임상시험 결과:
2022년 5월 6일 현재 최소 2개의 일선 전신 요법을 받은 위암/식도위접합 선암종(GC/GEJ) 환자 5명과 최소 1개의 일선 요법을 받은 환자 5명을 포함하여 총 14명의 환자가 등록되어 9명의 환자를 치료했습니다. 위암/식도위접합부 선암종 환자의 하위군에서 객관적 반응률(ORR)은 완전 반응(CR) 1건을 포함하여 60%였습니다. 또한 종양 수축은 안정적인 질병 환자의 약 80%(4/5)에서 관찰되었습니다(4명의 췌장암 환자). 반응 기간 중앙값 및 무진행 생존 중앙값에 도달하지 못했습니다. DL1에서 관찰된 객관적 반응률(ORR)은 16.7%, 질병 통제율(DCR)은 50%였다. DL2에서 관찰된 객관적 반응률은 33.3%, 질병 조절률은 83.3%였습니다.
이 임상 시험의 데이터는 CT041이 과거 요법과 비교하여 이전에 여러 라인의 요법을 받은 위암 환자에서 항종양 활성을 상당히 개선할 수 있음을 보여줍니다.
(2) 진행성 위암/식도위 접합부 선암종 환자를 대상으로 한 중국에서의 임상 Ib/II 시험의 안전성 및 예비 효능 결과: 2021년 12월 22일 기준으로 14명의 위암/식도위접합부 선암 환자가 Ib상에 포함되었으며, 이 중 57.1%는 3개 이상의 전이 장기를 가지고 있었고 92.9%는 복막 전이를 가졌습니다. 대부분의 환자(85.7%)는 이전에 2차 요법 또는 fluorouracil, oxaliplatin 및 paclitaxel을 포함하는 삼중 요법을 받았습니다. 환자의 35.7%는 이전에 PD-1/PD-L1 억제제 요법을 받은 적이 있습니다. 결국 13명의 환자가 종양 평가를 받을 수 있었고 1명의 환자가 평가에서 제외되었습니다. 14명의 환자 중 8명(57.1%)이 CT041의 첫 번째 주입 후 첫 번째 종양 평가에서 부분 반응을 달성했으며, 연구자가 평가한 객관적 반응률과 질병 통제율은 각각 57.1%와 78.6%였습니다. 중앙 추적 기간은 8.8개월이었고, 중앙 무진행 생존(mPFS) 및 중앙 전체 생존(mOS)은 각각 5.6개월 및 10.8개월이었다. 데이터 컷오프 날짜 현재 7명의 환자가 아직 살아 있었습니다. 예비 연구 결과에 따르면 CT041은 진행성 위암/식도위 접합부 선암종을 앓고 있는 환자에서 상당한 효능과 관리 가능한 안전성을 가지고 있습니다.
53세 남성 예
간, 폐, 골 전이 및 다발성 림프절 및 복막 전이를 동반한 진행성 위암으로 PD-1 항체, CLDN18.2 등 2종의 전신치료를 받았고 60%(3+), CAR-T 치료 후 종양 거의 50% 축소, 32주 동안 관해 지속.
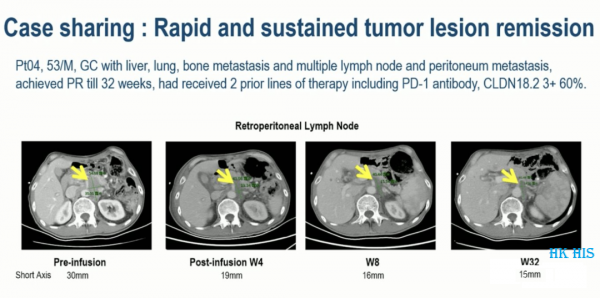
복막 전이 및 Mary Joseph's 결절(악성 종양이 배꼽으로 전이되어 형성된 결절성 병변)이 있는 GC, 이전에 PD-1 항체, CLDN18.2를 포함한 3가지 요법을 받은 80%(2+), CAR-T A 부분 반응 치료 후 달성되었으며 반응은 56주 동안 지속되었습니다.